Проведен логико-предметный анализ изучения темы «Металлы» в программе по химии, выделены и описаны структурные компоненты технологии «Сравнительной характеристики различных металлов», технология апробирована.
Основными задачами учителя является: способствовать формированию познавательных УУД через самостоятельное выделение цели, построение логической цепи рассуждений, анализ речевых ситуаций, выполнение заданий на анализ, сравнение, приведение доказательств, постановку учебной задачи, осуществление самоконтроля, построение логической цепи рассуждений.
Abstract: The capabilities of the technology "Comparative characteristics of various metals" for the success of the development of the concept of "Metals" by schoolchildren are demonstrated. This determined the need to highlight not only the content of knowledge, but also the content of activities that include specific UUD. Within the framework of modern requirements, we have made attempts to organize the activities of schoolchildren on the characteristics of metals not by groups, but in the process of comparing individual structural components in different groups of metals.
A logical-subject analysis of the study of the topic "Metals" in the program in chemistry was carried out, the structural components of the technology "Comparative characteristics of various metals" were identified and described, the technology was tested.
The main tasks of the teacher are: to promote the formation of cognitive UUD through self-selection of goals, building a logical chain of reasoning, analyzing speech situations, performing tasks for analysis, comparison, bringing evidence, setting a learning task, exercising self-control, building a logical chain of reasoning.
Keywords: organization, structural components, logical-objective analysis, universal learning activities
Особенностью содержания современного основного общего образования является не только ответ на вопрос, что обучающийся должен знать (запомнить, воспроизвести), но и формирование универсальных учебных действий в личностных, коммуникативных, познавательных, регулятивных сферах, обеспечивающих его развитие в самостоятельной учебной деятельности.
Уровень сформированности УУД в полной мере зависит от способов организации учебной деятельности обучающихся. Это определило необходимость выделить не только содержание знаний, но и содержание видов деятельности, включающих конкретные УУД.
Цель: Продемонстрировать возможности технологии «Сравнительной характеристики различных металлов» для успешности освоения школьниками понятия «Металлы».
Задачи:
- Провести логико-предметный анализ изучения темы «Металлы» в традиционной программе по химии;
- Выделить и описать структурные компоненты технологии «Сравнительной характеристики различных металлов»;
- Апробация технологии «Сравнительной характеристики различных металлов» в процессе формирования понятия «металлы» у школьников 9 класса; демонстрация ее результативности.
Гипотеза: Успешное освоение понятия «металлы» возможно если:
- характеристики понятия металлы изучаются не рядоположно, а в процессе сравнения отдельных структурных компонентов у различных групп металлов;
- при изучении темы используются различные формы организации учебной деятельности школьников (работа в группах, различные виды контроля и оценки и т. Д.)
Важнейшими темами химии 9-го класса являются «Неметаллы», «Металлы», «Знакомство с органическими веществами». На них отводится около 70 часов учебного времени. По действующей программе можно характеризовать каждую группу металлов отдельно, т.е. группа Ме является объектом характеристики.
В рамках современных требований нами предприняты попытки организации деятельности школьников по характеристике металлов не по группам, а в процессе сравнения отдельных структурных компонентов у различных групп металлов.
Таблица 1
Элементы программы
| Кол-во часов (Т) | Традиционно | Экспериментально | Кол-во часов
(Э) |
| 6 часов | Общая характеристика металлов | Актуализация знаний за курс 8 класса
Общая характеристика металлов I группы |
3 часа |
| 2 час | Металлы I группы А | Модуль №1
Химический элемент (Металлов I, II, III групп и металлов побочных подгрупп) |
2 час |
| 3 час | Металлы II группы А | Модуль №2
Простое вещество (Металлов I, II, III групп и металлов побочных подгрупп) |
3 часа |
| 2 час | Металлы III группы А | Модуль №3
Соединения химического элемента (Металлов I, II, III групп и металлов побочных подгрупп) |
3 часа |
| 3 час | Металлы побочных подгрупп | Модуль №4
Сравнительный анализ Ме различных групп |
2час |
| Модуль №5
Генетическая связь металлов |
2 часа | ||
| 6 часов | Практикум | Модуль №6
Практикум |
4 часа |
| Количество часов:
22 часа |
Количество часов:
19 часов (Оставшиеся часы можно использовать на решение задач) |
||
Т – традиционная программа
Э – экспериментальная технология «сравнительной характеристики различных металлов»
Технология сравнительной характеристики различных металлов включает 6 модулей
Модуль №1
Химический элемент (Металлов I, II, III групп и металлов побочных подгрупп)
Модуль №2
Простое вещество (Металлов I, II, III групп и металлов побочных подгрупп)
Модуль №3
Соединения химического элемента
(Металлов I, II, III групп и металлов побочных подгрупп)
Модуль №4
Сравнительный анализ Ме различных групп
Модуль №5
Генетическая связь металлов
Модуль №6
Практикум
К моменту изучения тем модулей школьники владеют следующими знаниями:
- Строение атома. Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева
- Периодический закон и периодическая система химических элементов Д.И. Менделеева
- Группы и периоды периодической системы. Физический смысл порядкового номера химического элемента.
- Закономерности изменения свойств элементов и их соединений в связи с положением в периодической системе химических элементов
- Строение вещества. Химическая связь.
- Простые и сложные вещества. Основные классы неорганических соединений.
Для актуализации знаний, необходимых для изучения темы «Металлы», учащиеся заполняют лист контроля:
Модуль №1
Химический элемент (оценивают свои возможности знаками «+», «-«, «v«).
- Знаю «адрес» элемента
- Умею изобразить схему строения атома
- Указываю степень окисления элемента «+» и «-»
- Записываю в общем виде окислительно-восстановительный процесс:
Э – окислитель: Ме + ne— → Ме-n (нет у металлов) , Э – восстановитель: Ме — ne— → Ме+n
- Составляю формулы высшего оксида, гидроксида RxOy, R(OH)x
(формируются регулятивные УУД: выявление и осознание того, что уже освоено, уровня усвоения)
Для выработки способа действия выделяются все характеристики понятия «Химический элемент». (фронтально)
Затем заполняется таблица №1 на примере металлов I A группы.
Таблица 2
Характеристика элементов I A группы
| 1. Выберите химический элемент из I A группы и укажите его положение в ПСХЭ | Натрий Nа, III период, I группа (главная п/гр), атомный номер Z =11 |
| 2. Составьте схему строения атома с указанием числа электронов в энергетических уровнях | В атоме 11 электронов 7N 2e— 8e— 1e—
+11 ﴿ ﴿ ﴿ 2 8 1 |
| 3. Составьте электронную конфигурацию атома | 11Na 1s2 2s2 2p63s1 |
| 4. Составьте схему распределения электронов по орбиталям (графическую формулу) | ↑
3s ↑↓ ↑↓ ↑↓ ↑↓ 2s 2p ↑↓ 1s |
| 5. Определите высшую положительную степень окисления элемента | +1 (Na+1) |
| 6. Вычислите низшую отрицательную с.о. элемента | — |
| 7. Установить Э – окислитель Ме + ne— → Ме-n , или Э – восстановитель Ме — ne— → Ме+n
|
Na — 1e— → Na+1 восстановитель
|
| 8. Составить формулу высшего оксида, гидроксида RxOy, R(OH)x, указать их характер
|
Na2O, NaOH |
Для отработки способа характеристики химического элемента
учащиеся в парах выполняют это же задание для металлов II, III групп и металлов побочных подгрупп.
Проверка осуществляется через документ-камеру выборочно с одновременной коррекцией.
Модуль №2
Вопрос: В каких формах еще может существовать атом химического элемента?
Ответ: Атомы входят в состав простых и сложных веществ.
Для изучения простого вещества Ме необходимо выделить структурные компоненты характеристики понятия «простое вещество». Во время фронтальной беседы выстраивается план характеристики простого вещества:
Характеристика простого вещества Ме
1) Тип химической связи (точечки)
2) Тип кристаллической решетки
3) Аллотропные видоизменения (если есть)
4) Физические свойства: а) агрегатное состояние, б) растворимость в воде, в) и т.д.
5) Химические свойства:
а) реакции с простыми веществами
б) реакции со сложными веществами
6) Получение:
а) в лаборатории
б) в промышленности
7) Применение
Для выработки способа характеристики простого вещества металла фронтально характеризуются металлы I группы.
Отработка способа действия.
Даем задания по отработке способа действия на примере различных групп металлов. (работа в группах)
Выполняется мини проект: распределяются обязанности (поиск информации, оформление, выступление)
Подобные задания позволяют ученикам развивать такие качества, как умение общаться, находить общий язык и уметь собирать информацию в единое целое.
Итог: защита проекта каждой группой с использованием документ-камеры.
Модуль №3.
Характеристика соединений Ме
- Выработка способа действия. Выделяются все характеристики понятия «Свойства соединений Ме».
- Оксиды: свойства, получение
- Основания: свойства, получение
- Кислоты: свойства, получение
- Соли: свойства, получение
- Водородные соединения: свойства, получение
- Отработка способа действия.
Даем задания по отработке способа действия на примере различных групп металлов.
Работа в группах
Итог: защита проекта каждой группой с использованием документ-камеры.
Модуль №4
Сравнительный анализ Ме различных групп
Задание: по группам (4 группы)
Первые две группы учеников сравнивают изменение свойств элементов, простых веществ, соединений металлов по группам ПС (вертикально).
Другие две группы учеников сравнивают изменение свойств элементов, простых веществ, соединений металлов по периодам ПС (горизонтально).
Проверка осуществляется через документ-камеру выборочно с одновременной коррекцией.
Таблица 3
Изменение свойств элементов
| Период
Группа |
Ra
уменьшается |
Ме свойства ослабевают | Заряд ядра увеличивается | Восстановительные свойства
ослабевают |
|
| Ra
увеличивается |
|||||
| Ме свойства
усиливаются |
|||||
| Заряд ядра
увеличивается |
|||||
| Восстановительные свойства
усиливаются |
|||||
Модуль №5.
Генетическая связь соединений Ме
- Выработка способа действия
Составляется всем классом в общем виде схема превращения веществ по генетическому ряду металлов (запись на доске)
Ме → МехОу → Ме(ОН)х → МехАу
Металл → оксид металла → гидроксид → соль (для Ме с растворимым гидроксидом)
Ме → МехАу → Ме(ОН)х → МехОу
Металл → соль → гидроксид → оксид (для Ме с нерастворимым гидроксидом)
Для определения уровня владения материалом проводим анкетирование:
- Отработка способа действия.
Даем задания по отработке способа действия на примере различных групп металлов.
1.Составить уравнения реакций по схемам генетической связи.
- Составить схему генетического ряда металла из предложенных веществ.
Na, MgCl2, P2O5, NaOH, P, MgO, H3PO4, Na2O, Na3PO4
Для определения уровня владения материалом проводится анкетирование:
Таблица 4
Анкета
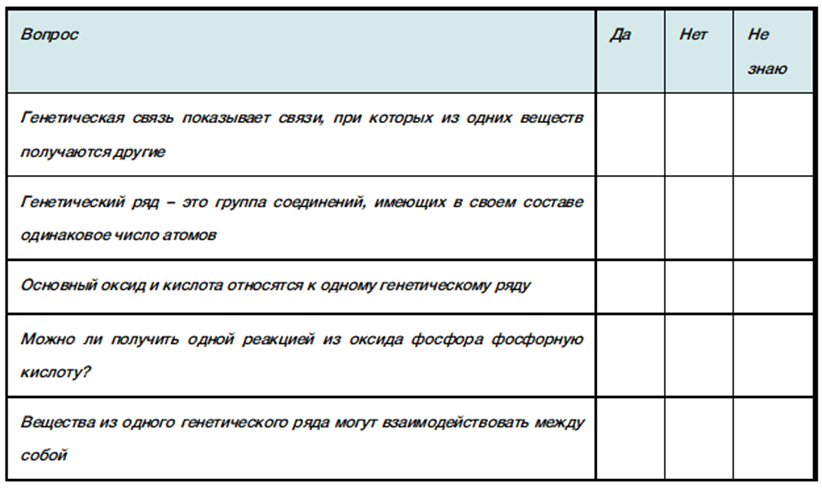
Работа в группах
Сравнить различные группы металлов: для этого выделить признаки сравнения и составить таблицу для заполнения другими группами:
Таблица 5
Признаки сравнения
| Признаки сравнения | 1группа | 2 группа | 3 группа | Побочная подгруппа |
| 1 признак | Признак указан | ——————- | ——————- | ——————- |
| 2 признак | ——————- | ——————- | ——————- | Признак указан |
| ? | Признак указан | ——————- | ——————- | ——————- |
| 3 признак | ——————- | ——————- | Признак указан | ——————- |
| Общий вывод | ||||
Обобщение идет по составлению блок-схемы (для разных групп металлов) по всем структурным компонентам.
Библиографический список
1. Новые педагогические и информационные технологии в системе образования [Текст]/ Под ред. Е.С. Полат. – М.: Аcademia, 2000.2. Фатхуллина, Л.Р. Интеграция компетентностного и культурологического подходов, в развитии корпоративной культуры студентов в проектно-творческой деятельности [Текст]/ Л.Р.Фатхуллина//, Образование и саморазвитие №2 (12) 2009. с.96-103.
3. Современные подходы к компетентностно-ориентированному образованию: Материалы семинара/ Под ред. А.В.Великановой. – Самара: Изд-во «Профи», 2001. 1. Богоявленская Д.Б. Пути к творчеству. - М: Знание,1981.-96с.-(Новое в жизни, науке, технике. Сер.»Педагогика и психология»;№10)
